北京时间2020年2月3日晚,Resverlogix公告核心品种RVX-208获得美国FDA突破性疗法认定(Breakthrough Therapy Designation)。
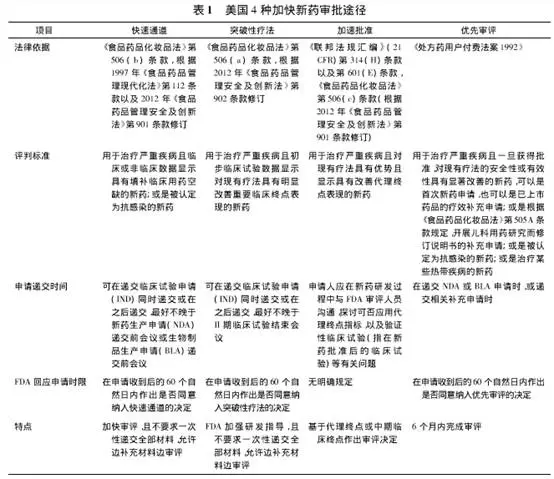
突破性疗法认定(BTD)通道由美国FDA在2012年7月设立,旨在加快用于治疗严重疾病、并在早期临床研发阶段展现良好疗效的药品的开发和注册流程。是FDA继快速通道(Fast Track)、优先审评(Priority Review)、加速批准(Accelerated Approval)之后的第四条特别审批通道。
突破性疗法是指被开发单用或与一种或多种其他药物联用于治疗严重或危及生命的疾病,且初步临床试验表明,在一个或多个有临床意义的终点指标上,该药较现有疗法有显着改善,如临床开发早期观察到的明显疗效。
获得BTD认定往往预示着该药物具有较高的上市可能性以及后续享受各种利好政策支持,根据规定,研发中的新药若获得突破性疗法的认定(BTD),将享受一系列优惠待遇,包括FDA 审评人员悉心指导设计有效的药物开发计画,有高级管理人员参与的政策和审评资源支援,以及滚动审评和优先审评的资格,可以显著加速新药的上市历程。
截止到目前为止,心脑血管领域仅有4个品种获得BTD资格认定,其中Andexxa 2018年获批上市,RVX-208为该领域的第五个品种;网络资料显示与中资企业相关的BTD认定仅有DKN-01(Therepeutic、百济神州)、JNJ-4528(杨森、南京传奇)、AT-GAA(Amicus)、BTK抑制剂zanubrutinib(百济神州);2019年FDA累计收到156份BTD申请,其中67份成功,68份失败、21份撤销申请,由此可见,其稀缺性。
RVX-208与包括高强度他汀类药物在内的最高治疗标准相结合,可用于二级预防2型糖尿病和近期急性冠脉综合征的主要不良心脏事件。与最高标准的治疗疗法相结合(包括高强度他汀类药物在内),是满足主要未满足需求的一种新颖方法。
RVX-208获得BTD认定虽然并不是百分之百上市确保,但一定程度上意味着其前期临床试验数据获得认可,未来成药的可能性提高,Resverlogix与FDA的密切合作将促使高效的药物开发计划,包括计划的临床试验和加快的制造发展战略计划、以及商业化。
我们认为,1、海普瑞持有Resverlogix40.03%股权,且拥有RVX-208的大中华区权益,RVX-208获得BTD认定,未来成药可能性提高,公司将直接受益;2、海普瑞海外投资多个创新药品种,重点品种研发阶段性突破激励公司持续研发创新投入的同时,也将有助于市场投资对其管线价值的认可,因此重申“强烈推荐评级”。
公告连接:
https://www.resverlogix.com/investors/news?article=660
风险提示:
新药研发不及预期、肝素粗品价格过快上涨、海外拓展不及预期。
本文转载自:长城证券

